보도자료
[약업닷컴 분석] 7월 바이오 3상 9건 승인…셀리드·레모넥스 "코로나19 백신 개발 끝까지 간다"
 1350약업신문
1350약업신문 코로나19 엔데믹 전환 후에도 백신개발 기업들은 코로나19 백신 개발을 지속하는 것으로 나타났다. 코로나19 바이러스가 종식되는 것은 불가하므로 전 세계에서 수요가 지속적으로 발생하기 때문이다.
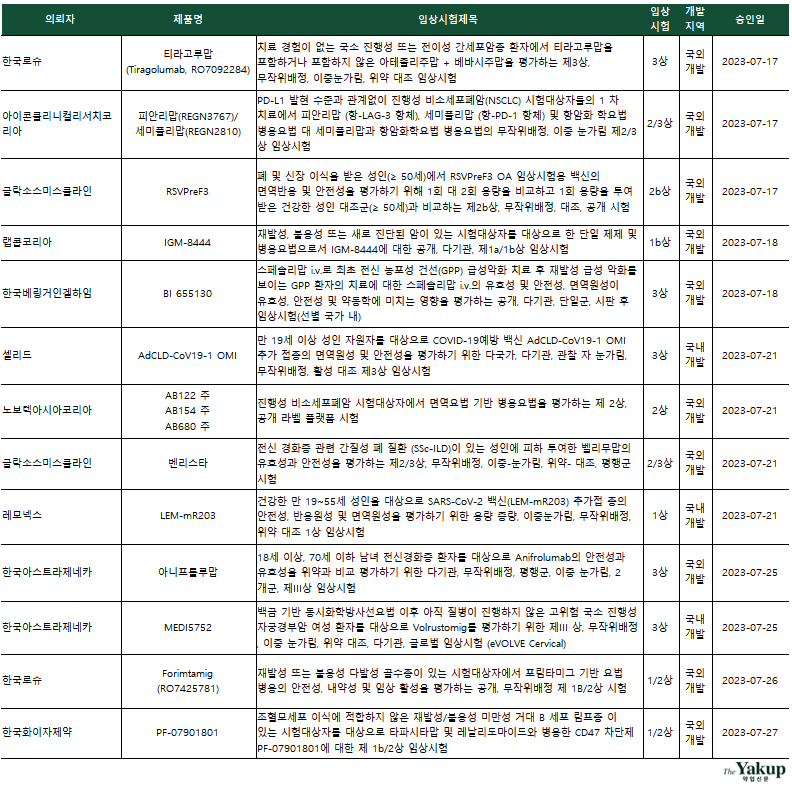
약업닷컴(약업신문)이 1일 한국바이오의약품협회 산업동향정보와 식품의약품안전처 의약품통합정보시스템 자료를 분석한 결과, 지난 7월 한 달간(1일~31일) 바이오의약품 IND(임상시험계획승인신청서)는 총 25건 승인됐다.
전체 승인된 IND 중 임상 3상과 임상 2상(2/3상 포함)은 각각 9건이었고, 임상 1상(1/2상 포함)은 7건으로 집계됐다. 임상 3상을 승인받은 기업은 △한국로슈 △아이콘클리니컬리서치코리아(CRO, Contract Research Organization) △노보텍아시아코리아(CRO) △한국릴리 △한국베링거인겔하임 △셀리드 △한국아스트라제네카로 나타났다. 이 중 한국로슈와 한국아스트라제네카가 2건을, 국내 기업은 셀리드가 유일하게 임상 3상을 승인받았다.
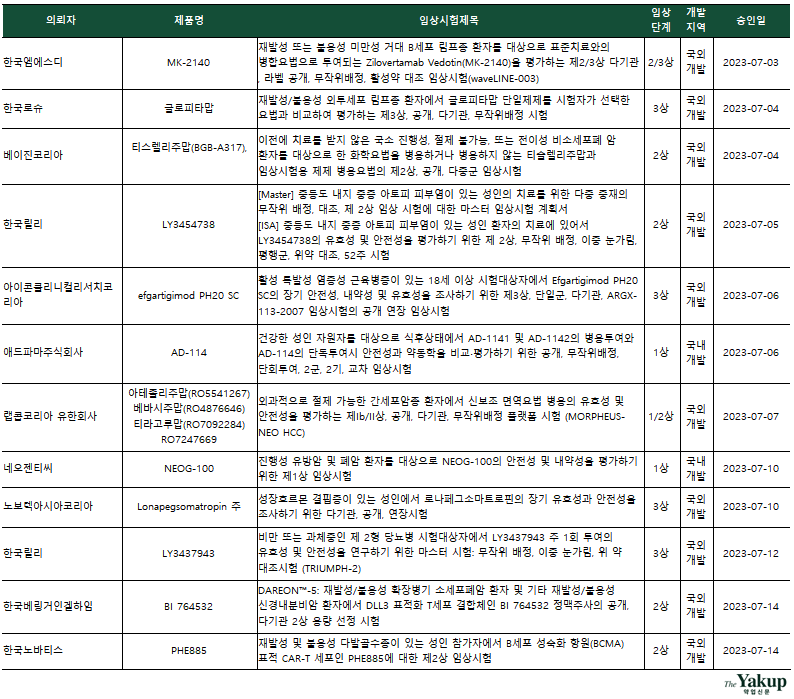
7월 승인된 바이오의약품 IND는 △림프종 △비소세포폐암 △아토피 피부염 △특발성 염증성 근육염 △간암 △유방암 △폐암 △다발성골수종 △당뇨병 등을 타깃하고 있다. 이외에 코로나19 백신 개발을 위한 임상 3상과 새로운 전달체가 적용된 코로나19 백신 개발 목적의 임상 1상이 승인돼 눈길을 끈다. 백신개발 기업들은 코로나19 백신이 독감 백신과 같이 매년 수요가 상당할 것으로 예측, 개발을 끝까지 한다는 입장이다.
실제로 엔데믹 상황에서도 코로나19 감염자는 꾸준히 나오고 있다. 질병관리청에 따르면 7월 25~31일 1주간 총 31만8706명이 코로나19에 확진됐다. 하루 평균 4만5000명이 넘게 코로나19에 감염되고 있다. 특히 26일에는 5만7720명이 확진 판정을 받았다. 2020년 1월 코로나19 팬데믹 이후 약 3년 6개월이 지났지만, 아직도 코로나19가 지속되는 실정이다.
코로나19 백신 관련 임상을 승인받은 기업은 셀리드와 레모넥스다. 셀리드는 7월 21일 코로나19 변이바이러스 오미크론 전용 백신 ‘AdCLD-CoV19-1 OMI’의 임상 3상을 승인받았다. 이 백신은 아스트라제네카와 얀센의 코로나19 백신과 같은 바이러스벡터 기반으로 이뤄졌다. 셀리드는 코로나19 백신 마지막 접종자와 코로나19 확진 후 최소 16주 이상 지난 성인 4000명을 대상으로 국내와 베트남 등에서 글로벌 임상 3상을 진행할 계획이다.
셀리드 관계자는 “코로나19 백신은 전 세계에서 매년 28억 도즈(Dose)가 사용될 전망”이라며 “이미 여러 코로나19 백신이 개발됐지만, 변이에 신속하게 대응할 수 있는 고품질의 코로나19 백신은 여전히 큰 시장경쟁력을 가진다”고 말했다. 셀리드는 AdCLD-CoV19-1 OMI 개발 성공이 자사 백신 개발 플랫폼의 우수성과 시장성을 증명, 글로벌 백신개발 기업으로 발돋움할 계기라고 강조했다.
셀리드는 자체 개발한 백신 개발 플랫폼 △슈도바이러스 라이브러리 △아데노바이러스 벡터 플랫폼을 구축했다. 이 플랫폼들은 코로나19 바이러스 변이에 따른 표적을 목표로 3~4개월 이내에 상업용 대량생산까지 가능하게 하는 기술이다. 특히 AdCLD-CoV19-1 OMI는 임상 2상 중간 결과에서 접종 후 4주 시점에 오미크론 변이에 대한 중화항체가가 접종 전 대비 3.49배 증가한 것이 입증됐다. 또 코로나19 감염 이력이 없는 대상자에서 중화항체 투여 후 4주 시점에 접종 전 대비 10.08배 증가한 결과가 확인됐다. 이는 글로벌 빅파마의 백신 효력을 능가하는 수준으로, 업계에선 이번 임상 3상 결과도 긍정적으로 전망했다.
레모넥스는 7월 25일 'LEM-mR203'의 임상 1상을 승인받았다. 이번 임상 1상은 서울대학교병원에서 진행된다. LEM-mR203은 LNP(지질나노입자, Lipid Nanoparticles)의 한계를 보완할 수 있는 약물전달 플랫폼 기술 ‘디그레더볼(DegradaBALL®)’이 적용된 mRNA 백신이다.
mRNA 기반 백신은 인체 내에서 쉽게 분해돼, 약물전달물질로 LNP가 주로 사용된다. 화이자와 모더나의 코로나19 백신이 대표적이다. 그러나 LNP는 심근염과 심낭염을 비롯한 전신에서 아나필락시스 부작용이 발생할 수 있다. 또 초저온 보관이 필요해 전 세계에 널리 사용되기 어렵다.
레모넥스는 이러한 LNP 한계를 독자 개발한 디그레더볼 약물전달 플랫폼이 해결할 수 있다고 강조했다. 또 백신개발뿐만 아니라 희귀유전질환 치료제 등 다양한 신약개발에 활용할 수 있는 우수한 플랫폼이라고 덧붙였다.
- 이전글



